UDI的构成 UDI的实施流程
UDI是医疗器械产品的唯一标识的简称,UDI有助于提高医疗器械的可追溯性和安全性。建立完整的UDI管理体系对于实施UDI的企业至关重要。这有助于满足监管要求,降低实施成本,提高管理效率,增强风险管控能力,达到降本增效的目的。
UDI由DI和PI构成
1.产品标识(DI):DI是产品静态信息,包括企业编码和产品ID。其中,企业编码由备案人申请,由符合我国医疗器械编码规则和标准的发码机构发出的,是具备唯一性的编码;产品ID是一段包含具体产品名称、包装等级、规格型号的编码。因此,由企业编码和产品ID组合而成的DI具备全球唯一性。
2.生产标识(PI):PI是产品动态信息,包括生产日期、失效日期、生产批次、序列号、校检位等。目前,PI编码暂不需要上传到药监局数据库,各使用单位可采用扫描设备直接获取产品相关生产信息。

UDI
UDI的实施主要包括4个环节
1.产品赋码:企业选择发码机构为产品及包装创建DI,并确定PI的组成。产品进入生产环节后,企业选择数据载体将UDI信息赋予产品的本体或包装上。企业可根据产品的质量管理体系和应用场景等因素选择适当的发码机构和数据载体。
2.数据上报:按照UDI实施要求,已实施UDI的品种,申请首次注册、延续注册或者注册变更时,企业须将DI数据提交到注册管理系统中。产品上市销售前,企业须将DI和相关信息上传至UDI数据库,并负责数据的动态维护,确保数据的真实、准确与完整。
3.数据共享:UDI数据库根据需要通过多种方式将DI数据共享给经营企业、医疗机构、政府相关部门及社会公众。
4.数据应用:DI与PI信息联合使用可实现医疗器械在流通和使用环节的精准识别和记录,有助于推动医疗器械监管的“三医联动”。
UDI系统的重要性
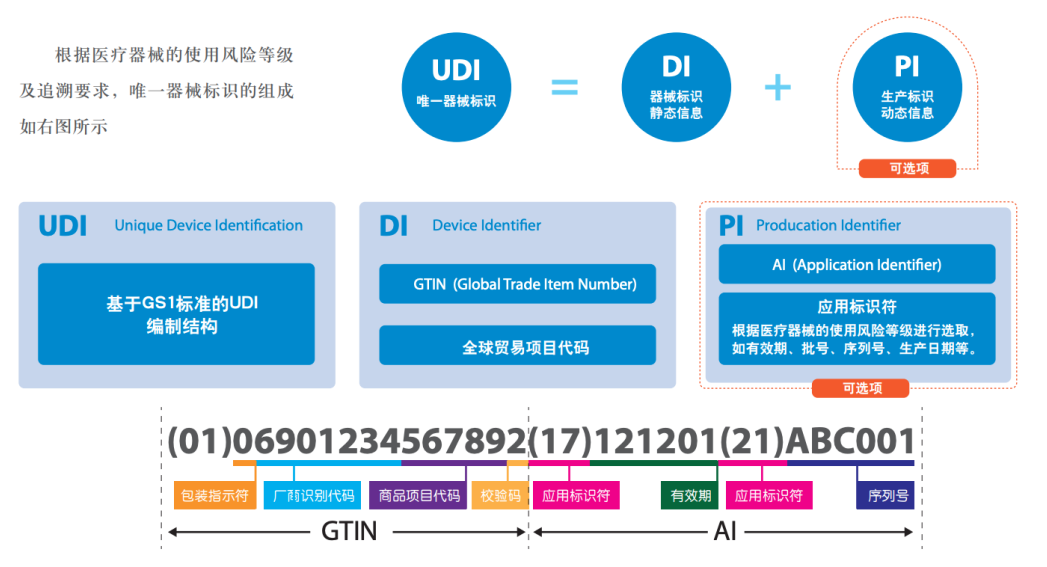
UDI的构成
展开全文
1.符合法规要求:许多国家和地区对医疗设备的标识和追溯提出了法规要求,UDI系统使企业能够轻松满足这些法规,避免潜在的法律责任。
2.提高患者安全:UDI系统使医疗机构和制造商能够快速准确地追踪和定位存在质量问题的医疗设备,从而降低患者使用可能有问题产品的风险。
3.支持产品召回:在发生产品缺陷或安全问题时,UDI系统能够快速定位受影响的产品,有助于迅速实施召回措施,降低召回的规模和影响范围。
4.提高供应链透明度:制造商可以通过UDI系统更好地管理产品在供应链中的流动,实现供应链的可见性,降低丢失和滞留的风险。
企业可以通过UDI系统,对医疗器械产品从厂家到经销商、终端医院进行全渠道数据的收集、处理和分析,做到数据实时对接管理和产品实时精准追溯,实现医疗器械产品全生命周期的追溯管理。
以上是中胜大数据为大家带来的"UDI的构成 UDI的实施流程"的相关内容,希望对大家有所帮助!









评论